/Fuente: Federación Bioquímica de la Provincia de Buenos Aires – FABA Informa/
Un estudio, liderado por investigadores del CONICET, describe el mecanismo de formación de agregados de la proteína p53 mutada, similar al que ocurre en el cerebro en enfermedades neurodegenerativas, que estimulan la progresión tumoral. Este nuevo conocimiento puede tener múltiples implicancias terapéuticas y de diagnóstico.
Por Ana M. Pertierra
Ya era bien conocida la función supresora tumoral del gen p53 que codifica una proteína del mismo nombre, p53, que actúa como un factor de transcripción y juega un papel vital en la prevención del desarrollo de tumores, lo que le ha valido el apodo de “guardián del genoma”, manteniendo la integridad del genoma y previniendo la proliferación de células con ADN dañado. Actuando como un punto de control en el ciclo celular, detiene la progresión del ciclo para permitir la reparación del ADN dañado o, en casos donde el daño es irreparable, inducir la apoptosis o muerte celular programada. Pero cuando esa proteína está mutada no cumple la función protectora.
En este último tiempo, se sabía que por algunas de esas mutaciones no solo pierde su función LOF (loss of function) sino que además adquiere una función tumorigénica nueva GOF (Gain of function). Y esto suscitó el interés de los científicos argentinos.
Ahora, un estudio publicado en el Biophysical Journal (https://doi.org/10.1016/j.bpj.2025.04.009) liderado por el investigador del CONICET Gonzalo de Prat Gay determinó el mecanismo por el cual p53 forma estos amiloides, y comprobó que es sorprendentemente similar a lo que ocurre en el cerebro en enfermedades como el Alzheimer y el Parkinson. Lo hace a través de los llamados “condensados biomoleculares”, un concepto revolucionario dentro de la biología y que define a ciertas estructuras efímeras y relevantes en el interior de las células, que recuerdan a las gotas que se forman en una vinagreta, donde dos líquidos de distintas propiedades conviven sin mezclarse.
Aires (IIBBA, CONICET-FIL) y jefe del Laboratorio de Estructura-Función e Ingeniería de Proteínas de la Fundación Instituto Leloir (FIL), quien brindó detalles de esta investigación que no solo profundiza el conocimiento sobre el cáncer asociado al p53, sino que además contribuye a la comprensión del mecanismo general de la formación de condensados biomoleculares, un proceso descubierto en los últimos años que participa en una gran cantidad de reacciones químicas de la función celular normal, pero también en patologías neurodegenerativas, virales y oncológicas.
¿Cuál es el nuevo conocimiento generado por su grupo de investigación que involucra la formación de agregados de proteína p53?
Hasta ahora se ha visto que la proteína p53 forma agregados tipo amiloide pero estos no han sido caracterizados sobre la proteína pura y en su completa extensión, que es lo que permite un abordaje químico y biofísico exhaustivo. La proteína pura es de muy difícil producción y manipulación, algo en lo que nuestro laboratorio tiene el conocimiento.

La proteína p53 puede formar condensados líquidos que evolucionan a amiloides, proceso que estaría ligado a la capacidad de p53 mutada de estimular la progresión tumoral. Imágenes de microscopías de luz brillante, fluorescencia, fuerza atómica y electrónica.
En este trabajo mostramos que el camino hacia los agregados amiloides tiene como etapa inicial la formación de condensados biomoleculares, y definimos cuáles son los principios para que estos se formen. Asimismo, describimos el mecanismo cinético (secuencia de eventos y pasos limitantes) de condensación que impacta no solo en p53 sino en los procesos de condensación en general relacionados a toda la biología tanto eventos fisiológicos como patológicos.
¿Dónde y por qué mecanismo se forman esos condensados proteicos y cómo actuarían en favor del desarrollo del tumor?
Tanto los agregados amiloides como los condensados de p53 se están comenzando a estudiar. Se encuentran mayormente en el citosol y se producen cuando sube abruptamente la concentración de p53 debido a estrés celular o por mutación. Se sabe que pueden favorecer la progresión tumoral pero no se sabe el mecanismo molecular. Este trabajo sienta las bases para buscar los posibles blancos celulares, que es el próximo paso, si podemos darlo.
¿Qué tipos de tumores se desarrollan en esas condiciones?
P53 está mutada en el 50% de todos los cánceres. No está claro que esto ocurra en todos los casos, pero puede que sea un mecanismo general causado por la mutación de p53 en sitios de alta frecuencia de mutación.
¿Qué semejanza tienen esos agregados proteicos con los ya descriptos de proteína tau y beta-amiloide en enfermedades neurodegenerativas como Alzheimer?
El factor común es la formación de condensados, seguida por rutas de agregación amiloide, aunque todavía no está claro que forme fibras regulares p53. Pero muestra equilibrios fisicoquímicos similares para proteínas que son muy diferentes, para lograr la acumulación de formas perjudiciales de las proteínas, en un caso acelerando el cáncer, en otro causando toxicidad a neuronas.

De izq. a der.: Gonzalo de Prat Gay (director del trabajo), Gabriela Camporeale, Silvina Borkosky (autora principal), Araceli Visentin, Catalina Pirro y Cynthia Zizola, del laboratorio que dirige Prat Gay.
¿Cómo se realizó el diseño experimental, con qué muestras trabajaron y con qué tecnologías?
No trabajamos con muestras humanas. Trabajamos con la proteína p53 humana (y variantes de sus dominios) producida en forma recombinante en bacterias y purificada. Utilizamos microscopía óptica, de fluorescencia, de fuerza atómica y métodos espectroscópicos (absorción, dispersión de luz láser).
¿De qué modo este aporte científico podría aplicarse a futuras estrategias terapéuticas y diagnósticas del cáncer?
Se describió la presencia de agregados de p53 en ciertos tipos de tejidos cancerosos, y se mostró una correlación con la prognosis. No se sabe exactamente la naturaleza de las estructuras en estos tejidos, ni las que son liberadas. El desarrollo de anticuerpos que reconozcan las formas agregadas y no la p53 nativa tiene valor pronóstico. Además, se vio que los pacientes con elevado nivel de agregados tenían mejor sobrevida y mayor respuesta humoral. Esto por un lado implica que se puede apuntar a determinar antígenos relacionados con p53 aberrante circulando en el suero. Por otro lado, de establecerse la correlación de que estos antígenos aberrantes pueden generar respuesta inmune, abre la posibilidad de inmunnoterapia basada en la producción de estos antígenos aberrantes y su uso terapéutico.
Nuestro laboratorio cuenta con la tecnología para, generar antígenos amiloideos o aberrantes, producir anticuerpos monoclonales de alta especificidad, montar ensayos tanto para inmunohistoquimica como para ensayos de inmunoserologia. También tiene la capacidad de producir tales antígenos a escala para su eventual prueba como inmunoterapéuticos.
No obstante, este proyecto y el laboratorio carecen de la mínima financiación para ser continuado, tanto en su estado actual fundamental, como para sus posibles aplicaciones derivadas.
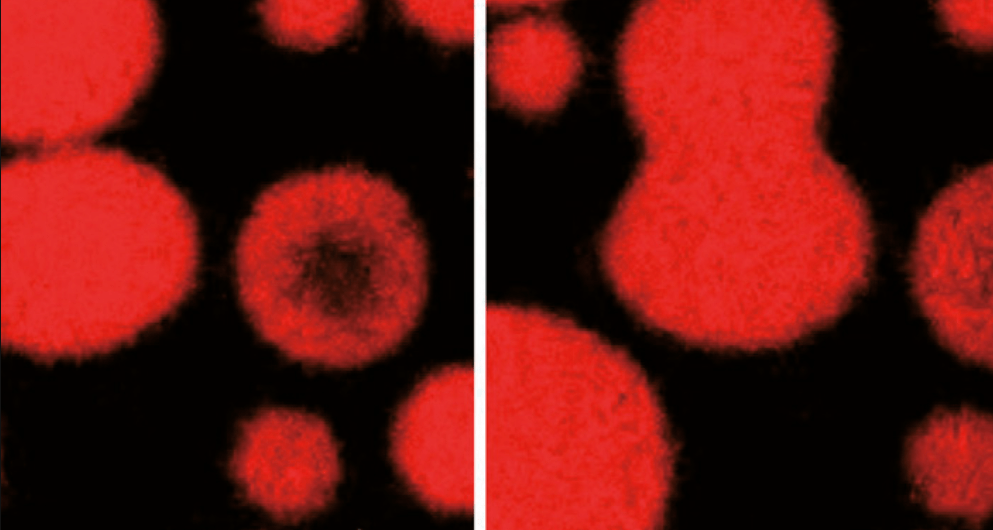
 Microscopía de fluorescencia que muestra los condensados (gotas) de p53 fusionándose y demostrando su naturaleza líquida y dinámica.El gen p53, conocido también como TP53, es uno de los genes más estudiados en la medicina moderna debido a su papel crucial en la regulación del ciclo celular y su implicación en la prevención del cáncer. Este gen codifica una proteína del mismo nombre, p53, que actúa como un factor de transcripción y juega un papel vit al en la prevención del desarrollo de tumores, lo que le ha valido el apodo de “guardián del genoma”.La función principal de la proteína p53 es mantener la integridad del genoma y prevenir la proliferación de células con ADN dañado. Actúa como un punto de control en el ciclo celular, deteniendo la progresión del ciclo para permitir la reparación del ADN dañado o, en casos donde el daño es irreparable, inducir la apoptosis o muerte celular programada. De esta manera, p53 ayuda a prevenir la acumulación de mutaciones genéticas que podrían conducir a la transformación maligna de las células.En condiciones normales, los niveles de la proteína p53 son relativamente bajos dentro de la célula. Sin embargo, en respuesta al daño del ADN, estrés celular, hipoxia, o ciertos agentes quimioterapéuticos, se activa p53, lo que lleva a un aumento en su concentración y actividad. Una vez activada, p53 puede iniciar una variedad de respuestas celulares. Por ejemplo, puede activar genes implicados en la reparación del ADN, lo que permite a la célula corregir el daño antes de continuar con la división celular. Si el daño es demasiado extenso, p53 puede inducir la apoptosis para eliminar la célula dañada y prevenir la propagación de mutaciones.El gen p53 es un tumor supresorLo que significa que su función normal ayuda a prevenir el desarrollo de cáncer. Las mutaciones en el gen p53 son una de las anomalías genéticas más comunes en los cánceres humanos. Estas mutaciones pueden ser heredadas (como en el síndrome de Li-Fraumeni) o adquiridas, y suelen resultar en la pérdida de la función normal de p53 o en la producción de una forma alterada de la proteína que no puede ejercer adecuadamente su rol en la vigilancia del genoma. Esto puede llevar a una mayor susceptibilidad al cáncer debido a la acumulación de mutaciones genéticas. Microscopía de fluorescencia que muestra los condensados (gotas) de p53 fusionándose y demostrando su naturaleza líquida y dinámica.El gen p53, conocido también como TP53, es uno de los genes más estudiados en la medicina moderna debido a su papel crucial en la regulación del ciclo celular y su implicación en la prevención del cáncer. Este gen codifica una proteína del mismo nombre, p53, que actúa como un factor de transcripción y juega un papel vit al en la prevención del desarrollo de tumores, lo que le ha valido el apodo de “guardián del genoma”.La función principal de la proteína p53 es mantener la integridad del genoma y prevenir la proliferación de células con ADN dañado. Actúa como un punto de control en el ciclo celular, deteniendo la progresión del ciclo para permitir la reparación del ADN dañado o, en casos donde el daño es irreparable, inducir la apoptosis o muerte celular programada. De esta manera, p53 ayuda a prevenir la acumulación de mutaciones genéticas que podrían conducir a la transformación maligna de las células.En condiciones normales, los niveles de la proteína p53 son relativamente bajos dentro de la célula. Sin embargo, en respuesta al daño del ADN, estrés celular, hipoxia, o ciertos agentes quimioterapéuticos, se activa p53, lo que lleva a un aumento en su concentración y actividad. Una vez activada, p53 puede iniciar una variedad de respuestas celulares. Por ejemplo, puede activar genes implicados en la reparación del ADN, lo que permite a la célula corregir el daño antes de continuar con la división celular. Si el daño es demasiado extenso, p53 puede inducir la apoptosis para eliminar la célula dañada y prevenir la propagación de mutaciones.El gen p53 es un tumor supresorLo que significa que su función normal ayuda a prevenir el desarrollo de cáncer. Las mutaciones en el gen p53 son una de las anomalías genéticas más comunes en los cánceres humanos. Estas mutaciones pueden ser heredadas (como en el síndrome de Li-Fraumeni) o adquiridas, y suelen resultar en la pérdida de la función normal de p53 o en la producción de una forma alterada de la proteína que no puede ejercer adecuadamente su rol en la vigilancia del genoma. Esto puede llevar a una mayor susceptibilidad al cáncer debido a la acumulación de mutaciones genéticas. |